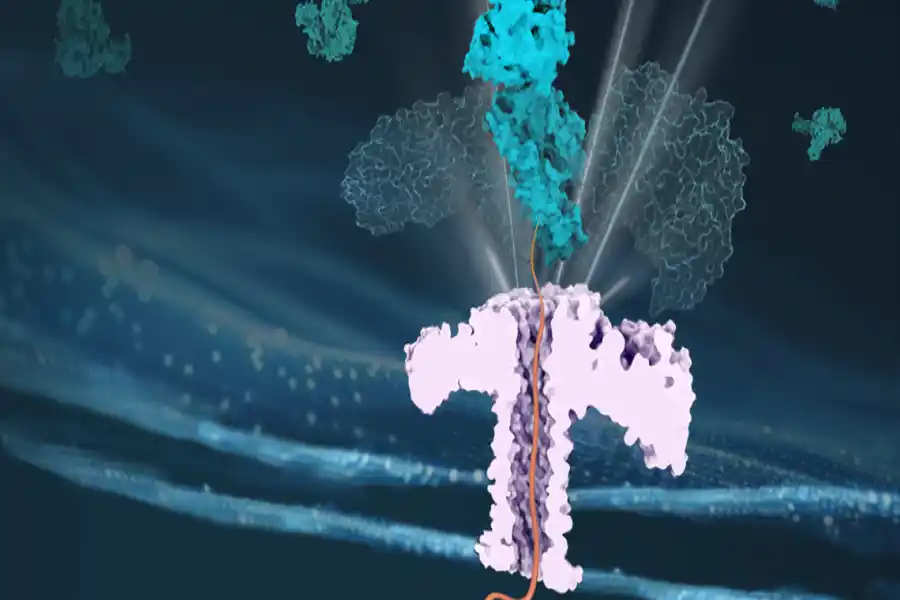
Chaperoni-proteiini helpottaa toisen proteiinin kulkua nanoporin läpi, varmistaen näin sen tehokkaan kuljetuksen.
Eläin- ja ihmis soluissa Hsp70-luokan chaperonit ovat tämän valvontajärjestelmän keskiössä, valvoen laajaa valikoimaa biologisia prosesseja. Huolimatta niiden ratkaisevasta roolista, niiden tarkka molekulaarinen mekanismi on pysynyt käsittämättömänä.
Geneven yliopiston (UNIGE) ja EPFL:n yhteistyöryhmä on tehnyt merkittävän läpimurron käyttämällä huipputeknologiaa nanoporeissa, selvittäen, miten Hsp70 tuottaa tarvittavan voiman manipuloidakseen asiakasproteiinien rakennetta. Nämä tulokset, jotka päättävät vuosikymmenen kestäneen keskustelun, on julkaistu Nature Communications -lehdessä.
Toimiakseen oikein proteiinien on taittuttava tiettyihin kolmiulotteisiin muotoihin. Chaperoniproteiinit, kuten Hsp70, auttavat erityisesti tässä taittumisessa. Näiden tehtävien suorittamiseksi Hsp70:n on voimakkaasti manipuloitava proteiinien rakennetta, vetämällä niitä pois spontaanisti muodostuneista aggregaateista tai kuljettamalla niitä kapeiden aukkojen läpi solun keskeisiin osastoihin, kuten mitokondrioihin.
Tiimi hyödynsi nanopore-teknologiaa toistaakseen in vivo -konfiguraation proteiinien translokaatioon.
1990-luvulla ja 2000-luvun alussa Hsp70-chaperonien mekanismia proteiinien translokaatiossa käsiteltiin intensiivisesti. Kaksi päämallia ehdotettiin eri kokeiden perusteella, mutta lopullista vastausta ei saatu.
Vuonna 2006 professori Paolo De Los Rios EPFL:stä ja professori Pierre Goloubinoff Lausannen yliopistosta (UNIL) esittivät uuden teorian, jota kutsutaan entropiseksi vetämiseksi (Entropic Pulling). Entropinen vetäminen voisi selittää kaikki olemassa olevat havainnot proteiinien translokaatiossa mitokondrioissa. Se voisi myös soveltua Hsp70:n muihin solutoimintoihin, kuten proteiinien hajoamiseen.
Kokeellinen todistus
Vuosien varrella tämä teoria on mahdollistanut yhä kasvavien tulosten tulkitsemisen, mutta se oli jäänyt ilman suoraa kokeellista vahvistusta. Chan Caon ryhmä, joka on assistenttiprofessori UNIGE:n analyyttisen ja mineraalikemian osastolla, on erikoistunut yksittäisten molekyylien bioanalyysiin, erityisesti nanoporeiden avulla.Tämä lähestymistapa perustuu ionivirran vasteen lukemiseen, kun molekyyli kulkee nanomittakaavan aukon läpi. Pore voi koostua biologisesta proteiinista, joka on upotettu lipidikalvoon tai valmistetusta kiinteästä materiaalista. Nanopore-teknologian kehittämisen tavoitteena on luoda korkean resoluution antureita kohdemolekyylien havaitsemiseksi monimutkaisissa matriiseissa ja polymeerien sekvensoinnissa.
Tässä tuoreessa työssä tiimi hyödynsi nanopore-teknologiaa toistaakseen in vivo -konfiguraation proteiinien translokaatioon. Professori Chan Cao selittää: "Tuloksemme tarjoavat selvää näyttöä Hsp70-chaperonien entropisesta vetomekanismista, hyläten kaksi aiemmin ehdotettua mallia, nimittäin Power Stroke ja Brownian Ratchet".
Voimakas voima molekyylitasolla
Entropisen vetämisen mekanismissa chaperoniproteiini, vetäessään kohdeproteiinia, lisää sen liikemahdollisuuksia, jolloin syntyy niin kutsuttua entropista voimaa. Verena Rukes, väitöskirjatutkija ja tutkimuksen ensimmäinen kirjoittaja, selittää: "Analyysimme arvioi entropisen vetovoiman olevan noin 46 pN 1 nm:n matkalla, mikä osoittaa huomattavan voimakasta voimaa molekyylitasolla".Paolo De Los Rios EPFL:n fysiikan ja bioinsinöörin instituutista jatkaa: "Vuonna 2006 ehdottamamme teoria selitti suurimman osan Hsp70:ää, translokaatio proteiinia ja translokaatio aukkoa käsittävän järjestelmän fysiikasta, mutta se jäi lopulta teoriaksi, vaikka se oli epäsuorasti sopusoinnussa useimpien havaintojen kanssa.
Professori Chan Caon ja hänen tiiminsä upean työn ansiosta meillä on nyt suora todiste tästä teoriasta ja, mikä tärkeintä, kvantitatiivinen arvio sen voimasta. Tämä osoittautuu olevan huomattavan korkea, mikä selittää, miksi Hsp70:t ovat niin tehokkaita muuttaessaan kohdeproteiinien rakennetta".
Lisäksi tämä työ vahvistaa nanopore-havaitsemismenetelmän voimakkaana tekniikkana proteiinien toiminnan molekulaaristen mekanismien tutkimiseen.